İçerik
Kimyada, değerlik elektronları bir elemanın en dıştaki elektronik katmanında bulunanlardır. Belirli bir atom için değerlik elektronlarının sayısının nasıl bulunacağını bilmek kimyagerler için önemli bir beceridir, çünkü bu bilgi atomun oluşturabileceği kimyasal bağların türünü belirler. Neyse ki, bu sayıyı bulmak için sadece standart bir periyodik tabloya ihtiyacınız var.
Adımlar
Bölüm 1/2: Periyodik tablo ile değerlik elektronlarını bulma
Geçişsiz metaller
Bir tane bul periyodik tablo. Renklere göre kategorize edilmiş ve insanoğlunun bildiği tüm kimyasal elementleri listeleyen birkaç farklı kareden oluşan bir tablodur. Elementler hakkında pek çok bilgi açığa çıkarır ve bunların bir kısmını araştırdığımız atomdaki değerlik elektronlarının sayısını belirlemek için kullanacağız. Bu tablolar genellikle kimya kitap kapağının içinde bulunabilir. Ayrıca burada çevrimiçi olarak kullanılabilen mükemmel bir etkileşimli masa var

Her sütunu 1'den 18'e kadar etiketleyin. Genel olarak, periyodik tabloda, aynı dikey sütunun tüm elemanları aynı sayıda değerlik elektronuna sahip olacaktır. Tabloda numaralandırılmış sütunlar yoksa, her birine en solda 1'den başlayıp en sağda 18'e kadar bir sayı verin. Bilimsel terimlerle sütunlara "gruplar" öğelerin.- Örneğin, grupların numaralandırılmadığı bir tabloyla çalışıyorsak, Helyum (He) hakkında 18 ile bitene kadar Hidrojen (H) hakkında 1, Berilyum (Be) hakkında 2 vb. Yazacağız.

Tabloda söz konusu öğeyi bulun. Bunu yapmak için kimyasal sembolü (her bir kutudaki harfler), atom numarasını (her kutunun sol üstündeki sayı) veya mevcut diğer bilgileri kullanabilirsiniz.- Örneğin, iyi bilinen bir element için değerlik elektronlarının sayısını bulalım: karbon (C), atom numarası 6 olan 14. grubun en üstünde yer alır. Bir sonraki adımda, değerlik elektronlarını bulacağız.
- Bu alt bölümde, 3'ten 12'ye kadar olan grupların oluşturduğu dikdörtgen bloğun elemanları olan geçiş metallerini göz ardı edeceğiz. Bu elemanlar diğerlerinden biraz farklıdır, bu nedenle bu alt bölümdeki adımlar onlar için geçerli olmayacaktır. Aşağıdaki alt bölümde bu unsurlarla nasıl başa çıkılacağını görün.

Değerlik elektronlarının miktarını belirlemek için grup numaralarını kullanın. Bir elementin bir atomunun kaç değerlik elektronuna sahip olduğunu bulmak için geçişsiz bir metalin grup numarasını kullanabilirsiniz. THE grup numarası birimi bu elementlerin bir atomunun değerlik elektronlarının sayısıdır. Diğer bir deyişle:- Grup 1: 1 değerlik elektronu.
- Grup 2: 2 değerlik elektronu.
- Grup 13: 3 değerlik elektronları.
- Grup 14: 4 değerlik elektronları.
- Grup 15: 5 değerlik elektronları.
- Grup 16: 6 değerlik elektronları.
- Grup 17: 7 değerlik elektronları.
- Grup 18: 8 değerlik elektronu (2'ye sahip helyum hariç).
- Örneğimizde, karbon 14. grupta olduğundan, bir karbon atomunun sahip olduğunu söyleyebiliriz. dört değerlik elektronu.
Geçiş metalleri
3 ile 12 arasındaki gruplardan bir eleman bulun. Yukarıda belirtildiği gibi, 3'ten 12'ye kadar olan gruplardaki elementlere "geçiş metalleri" adı verilir ve değerlik elektronları söz konusu olduğunda diğer elementlerden farklı davranırlar. Bu bölümde, bir dereceye kadar bu atomlara değerlik elektronları atamanın genellikle mümkün olmadığını açıklayacağız.
- Örnek olarak Tantalum (Ta), element 73'ü kullanalım. Sonraki adımlarda, veya deneyeceğiz değerlik elektronlarını bulun.
- Geçiş metallerinin, lantanit ve aktinit serilerini ("nadir toprak metalleri" olarak da adlandırılır), genellikle masanın geri kalanının altında konumlandırılan ve lantan ve aktinyum ile başlayan iki sıra içerdiğine dikkat edin. Bu elemanların tümü, 3. grup Periyodik tablonun.
Geçiş metallerinin "geleneksel" değerlik elektronlarına sahip olmadığını anlayın. Geçiş metallerinin neden periyodik tablonun geri kalanı gibi "çalışmadığını" anlamak, elektronların atomlarda nasıl davrandığına dair kısa bir açıklama gerektirir. Hızlı bir özet için aşağıya bakın veya doğrudan yanıtlara ulaşmak için bu adımı atlayın.
- Elektronlar bir atoma eklendikçe, elektronların toplandığı atomun etrafında temelde farklı alanlar olan farklı "orbitallere" dağıtılırlar. Genel olarak, değerlik elektronları en dıştaki kabuğun elektronlarıdır, yani en son eklenenlerdir.
- Burada açıklanamayacak kadar karmaşık nedenlerden dolayı, katmana elektronlar eklendiğinde d Bir geçiş metalinin en dış kısmı (aşağıya bakınız), giren ilk olanlar normal değerlik elektronları gibi davranma eğilimindedir, ancak bundan sonra artık bu şekilde davranmazlar ve diğer yörünge katmanlarından gelen elektronlar bazen bunun yerine değerlik elektronları olarak hareket ederler. Bu, bir atomun nasıl manipüle edildiğine bağlı olarak birkaç değerlik elektronuna sahip olabileceği anlamına gelir.
- İngilizce olarak daha ayrıntılı bir açıklama için, Clackamas Community College'daki değerlik elektronları hakkındaki mükemmel sayfaya bakın.
Grup numarasına göre değerlik elektronlarının miktarını bulun. Yine, incelediğiniz elementin grup numarası değerlik elektronlarınızı söyleyebilir. Bununla birlikte, geçiş metalleri için takip edebileceğiniz bir model yoktur, çünkü grup numarası genellikle bir dizi olası değerlik elektron numarasına karşılık gelir. Bunlar:
- Grup 3: 3 değerlik elektronları.
- Grup 4: 2 ila 4 değerlik elektronu.
- Grup 5: 2 ila 5 değerlik elektronu.
- Grup 6: 2 ila 6 değerlik elektronu.
- Grup 7: 2 ila 7 değerlik elektronu.
- Grup 8: 2 veya 3 değerlik elektronu.
- Grup 9: 2 veya 3 değerlik elektronu.
- Grup 10: 2 veya 3 değerlik elektronu.
- Grup 11: 1 veya 2 değerlik elektronu.
- Grup 12: 2 değerlik elektronu.
- Örneğimizde, Tantalus 5. grupta olduğu için aralarında var diyebiliriz. iki ve beş değerlik elektronuduruma bağlı olarak.
Bölüm 2/2: Elektronik bir konfigürasyonla değerlik elektronlarını bulma
Elektronik bir konfigürasyonu okumayı öğrenin. Bu, bir elementin değerlik elektronlarını bulmanın başka bir yoludur. İlk başta karmaşık görünebilir, ancak genellikle bir atomdaki elektron orbitallerini harfler ve sayılar kullanarak temsil etmenin bir yoludur ve neye baktığınızı bildikten sonra anlamak kolaydır.
- Örneğin, sodyum elementinin (Na) konfigürasyonuna bakalım:
- 1s2s2p3s
- Bu elektronik konfigürasyonun sadece aşağıdaki gibi tekrarlanan bir satır olduğunu unutmayın:
- (sayı) (harf) (sayı) (harf) ...
- ... ve bunun gibi. İlk blok (sayı) (harf) elektronik orbitalin adıdır ve o o orbitaldeki elektron sayısıdır. Bu kadar!
- Örneğimizde, sodyumun 1s yörüngesinde 2 elektron, çoğu 2s yörüngesinde 2 elektron, çoğu 2p yörüngesinde 6 elektron, çoğu 3s yörüngesinde 1 elektron. Toplamda 11 elektron var. Sodyum 11 numaralı elementtir, bu yüzden mantıklı.
- Örneğin, sodyum elementinin (Na) konfigürasyonuna bakalım:
İncelemekte olduğunuz elemanın elektronik konfigürasyonunu bulun. Bir elementin elektronik konfigürasyonunu öğrendikten sonra, onun değerlik elektronlarının sayısını bulmak oldukça basittir (tabii ki geçiş metalleri hariç). Yapılandırmayı alırsanız, sonraki adıma geçebilirsiniz. Bulmanız gerekirse, aşağıya bakın:
- Ununóctio (Uuo), element 118 için eksiksiz elektronik konfigürasyon:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Artık buna sahip olduğunuza göre, başka bir atomun elektronik konfigürasyonunu bulmak için yapmanız gereken tek şey, bu kalıbı baştan elektron bitene kadar doldurmaktır. Göründüğünden daha kolay. Örneğin, 17 elektronlu bir element olan Klorun (Cl) yörünge diyagramını yapmak istersek, aşağıdakileri yapacağız:
- 1s2s2p3s3p
- Elektronların toplamının 17: 2 + 2 + 6 + 2 + 5 = 17'ye eşit olduğuna dikkat edin. Yalnızca son yörüngenin numarasını değiştirmeniz gerekir; geri kalanı aynı olacaktır, çünkü önceki yörüngeler tamamen dolu olacaktır.
- Elektronik yapılandırma hakkında daha fazla bilgi edinmek için bu makaleyi de okuyun.
- Ununóctio (Uuo), element 118 için eksiksiz elektronik konfigürasyon:
Elektronları Sekizli Kuralı ile yörünge katmanlarına yerleştirin. Elektronlar herhangi bir atoma eklendiğinde, yukarıda verilen sırayla birkaç orbital girerler: ilk ikisi 1'leri, sonraki ikisi 2'leri, sonraki altı tanesi 2p'de vb. Geçiş metalleri olmayan atomlarla uğraşırken, bu orbitallerin atom etrafında katmanlar oluşturduğunu ve birbirini izleyen her katman öncekilerden daha uzak olduğunu söylüyoruz. Yalnızca 2 elektrona sahip olabilen ilk katmanın yanı sıra, her biri 8 elektrona kadar sahip olabilir (yine geçiş metalleri hariç). Bu çağrı Sekizli kuralı.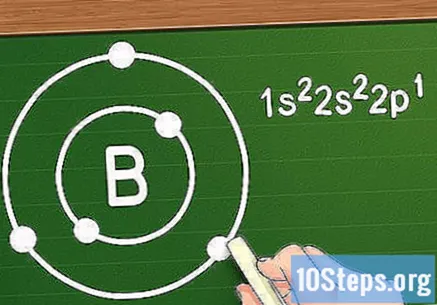
- Örneğin Bor (B) elementine baktığımızı varsayalım. Atom numarası beş olduğu için 5 elektrona sahip olduğunu ve elektronik konfigürasyonunun şu şekilde olduğunu biliyoruz: 1s2s2p. İlk yörünge katmanı sadece 2 elektron içerdiğinden, Bor'un iki katmanı olduğunu biliyoruz: biri iki 1s elektronlu ve diğeri 2s ve 2p orbitallerinden üç elektronlu.
- Başka bir örnek olarak, klor gibi bir elementin üç yörünge tabakası olacaktır: biri iki 1s elektronlu, diğeri iki 2s elektronlu ve altı 2p elektronlu ve diğeri iki 3s elektronlu ve beş 3p elektronlu.
En dıştaki kabuktaki elektron sayısını bulun. Artık elementinizin elektronik katmanlarını bildiğinize göre, değerlik elektronlarını bulmak kolay: sadece en dış katmandaki elektron sayısını kullanın. Bu katman doluysa (yani, sekiz elektrona sahipse veya birinci katman durumunda, 2), element inerttir ve başkalarıyla kolayca reaksiyona girmeyecektir. Yine de, kurallar geçiş metalleri için de geçerli değildir.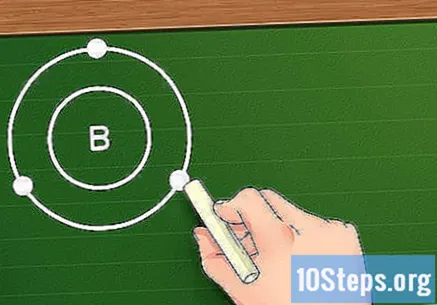
- Örneğin Bor ile çalışıyorsak, ikinci katmanda üç elektron olduğu için bu elementin sahip olduğunu söyleyebiliriz. üç değerlik elektronları.
Tablo çizgilerini yörünge katmanına kısayollar olarak kullanın. Periyodik tablonun yatay çizgilerine denir dönemler elementlerin. En baştan başlayarak, her bir periyot sayısı elektronik katmanlar bu satırdaki atomların sahip olduğu. Bu bilgiyi, bir elemanın kaç değerlik elektronuna sahip olduğunu belirlemek için bir kısayol olarak kullanabilirsiniz. Elektronları sayarken dönemin sol tarafından başlayın. Yine, bu yöntemi kullanırken geçiş metallerini göz ardı edin.
- Örneğin, selenyum elementinin dördüncü periyotta olduğu için dört yörünge tabakasına sahip olduğunu biliyoruz. Bu dönemde soldan altıncı element olduğu için (geçiş metallerini göz ardı ederek), dördüncü dış kabuğun altı elektrona sahip olduğunu ve bu nedenle Selenyum'un altı değerlik elektronu.
İpuçları
- Elektronik konfigürasyonların, konfigürasyonun başlangıcında orbitaller olarak görev yapmak için soy gazlar (grup 18'in elemanları) kullanılarak özetlenmiş bir biçimde yazılabileceğini unutmayın. Örneğin, sodyumun elektronik konfigürasyonu 3s1 olarak yazılabilir. Esasen, neon ile aynıdır, ancak 3s yörüngesinde ek bir element vardır.
- Geçiş metalleri tam olarak doldurulmamış değerlik alt katmanlarına sahip olabilir. Bu metallerdeki değerlik elektronlarının kesin sayısının belirlenmesi, bu makalenin kapsamı dışında kalan kuantum teorisinin ilkelerini içerir.
- Periyodik tabloların bir ülkeden diğerine farklılık gösterdiğini bilin, bu nedenle karışıklığı önlemek için doğru olanı kullanıp kullanmadığınıza bakın.
Gerekli malzemeler
- Periyodik tablo.
- Kalem.
- Kağıt.