İçerik
- aşamaları
- Bölüm 1 İyonik bir denklemin farklı elemanlarını anlama
- Bölüm 2 Net iyon denkleminin kurulması
Kimyada, net iyonik denklemler reaksiyonların temel gerçeklerini tanımlamaları bakımından çok faydalıdır. Yükseltgenme-indirgenme tepkimeleri, çift değiştirme tepkimeleri (veya birleşik ikameler) ve asit-baz nötralizasyonlarını hesaba katmak için sıklıkla kullanılırlar. Bir net iyonik denklem oluşturmak için, genellikle üç adımdan geçmek gerekir: moleküler denklemi dengeleyin, iyonik bir denkleme dönüştürün (yani, çözelti ile sonuçlanan türleri belirler) ve son olarak net iyonik denklemi kurun.
aşamaları
Bölüm 1 İyonik bir denklemin farklı elemanlarını anlama
-

Moleküler bileşikler ve iyonik. İyonik bir denklem ile yapılacak ilk şey iyonik bileşikleri bulmaktır. Bunlar sulu bir çözeltide çinkolaşacak olanlardır (iyonik çözelti), bu nedenle bir yük oluştururlar. Moleküler bileşikler elektriksel olarak nötrdür. Genellikle en az iki metal içermez ve bazen "kovalent bileşikler" olarak adlandırılırlar.- İyonik bileşikler, bir metal ile metal olmayan, metal ve poliamerik iyonlar arasındaki veya poliamerik iyonlar arasındaki reaksiyonun bir sonucu olarak ortaya çıkmaktadır.
- Bir bileşiğin doğasından çok emin değilseniz, onu oluşturan elementler için periyodik elementler tablosuna bakın.
-

Bileşiğin çözünürlüğünü tanımlayın. İyonik bileşiklerin hepsi sulu bir çözeltide çözünür değildir, oldukları gibi kalırlar ve herhangi bir iyon serbest bırakmazlar. Kimyasal denklem seviyesinde bir şey yapmadan önce her bileşiğin çözünürlüğünü tanımlamanız gerekir. Bazı çözünürlük kurallarını aşağıda bulabilirsiniz. Çözünürlük hakkında daha fazla bilgi için, nitel bir çözünürlük tablosuna bakınız.- Aşağıdaki tuzları yöneten bazı kuralları unutmayın:
- tüm Na, K ve NH tuzları4 çözünür
- tüm NO tuzları3, C2'H3Ey2, ClO3 ve ClO4 çözünür.
- tüm tuzlar Ag, Pb ve Hg2 çözünmez,
- Cl, Br ve I'nin bütün tuzları çözülebilir,
- tüm CO tuzları3, O, S, OH, PO4, CrO4, Cr2Ey7 ve SO3 çözünmez (istisnasız)
- tüm SO tuzları4 çözünür (istisnalar hariç).
-

Bir bileşiğin katyonunu ve dilimini belirleyin. Katyonlar, bir bileşiğin pozitif iyonlarıdır ve genellikle metal ailesine aittir. Anyonlar negatif, metalik olmayan iyonlardır. Bazı metal olmayanlar bazen katyonlar verebilirken, sadece metaller onları sistematik olarak verir.- Böylece, NaCl ile, Na pozitif olarak yüklenir, katyondur, çünkü metalik elementtir. Öte yandan, Cl negatif bir yüke sahiptir, bu bir lanyondur, çünkü molekülün metalik olmayan elementidir.
-

Poliatomik iyonları bir reaksiyonda nasıl tanıyacağınızı bilir. Kimyasal reaksiyon sırasında bağlarını kırması çok zor olan elektrik yüklü moleküllerdir. Her birinin belirli bir ücretle nasıl tanınacağını bilmek önemlidir. Onları oluşturan elementlere parçalanmayacaklar. Poliyatomik iyonlar pozitif olarak yüklenebilir (polyatomik katyonlar) veya negatif (polyatomik anyonlar).- Lisede, seviyeye bağlı olarak, en sık rastlanan polyatomik iyonların bazılarını hatırlamanız istenecektir.
- Kimyada en sık rastlanan polyatomik iyonlar şunlardır: CO3, NO3, NO2SO4SO3, ClO4 ve ClO3 .
- Çok daha fazlası var, bunları kimya kitabınızda veya internette ücret kategorisine göre gruplandırılmış bulacaksınız.
Bölüm 2 Net iyon denkleminin kurulması
-
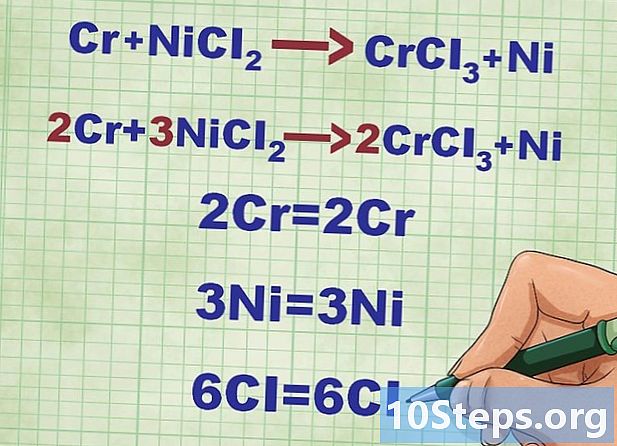
Moleküler denklemi dengeleyin. Net iyonik denklemi yazmadan önce, başlangıçtaki kimyasal reaksiyon denkleminin dengeli olduğundan emin olmalısınız.Bunun için, denklemin bir tarafında ve diğer tarafında her türden birçok datagramınız olmalıdır. Bu nedenle reaksiyonun dengelenmesi için bu veya o elementin katsayılarını (sağa veya sola) koymak genellikle gerekli olur.- Tepki al: Cr + NiCl2 -> CrCl3 + Ni. Denklemin her iki tarafındaki tüm elementlerin datom sayısını sayın. Cr ve Ni atomları dengelidir.
- Klor atomlarını (Cl) dengeleyin. Solda iki, sağda üç var. Dengelemek için, solda bir 3, sağda bir 2 eklemeliyiz, Cr ve Ni dengesizdir.
- Sağ nikel atomlarını dengeleyin (3Ni).
- Soldaki krom atomlarını dengeleyin (2Cr).
- Veri numarasının denklemin her iki tarafında aynı olup olmadığını kontrol edin.
- Öyleyse, Cr + NiCl2 -> CrCl3 + Ni 2Cr + 3NiCl olur2 -> 2CrCl3 + 3Ni.
-

Her bileşiğin fiziksel durumlarını tanımlayın. Denklemde görünmeleri gerekecek. Çoğu zaman, alıştırmanın ifadesi, belirli bir bileşiğin, en azından başlangıç halinin durumunun bir göstergesidir. Fiziksel durumlar size verilmezse, onları bulmanın başka yolları da vardır.- Bir elementin maddi durumu size verilmezse, periyodik element tablosundan alın.
- Bir bileşik bir "çözelti" olarak nitelenirse, kesinlikle "sulu" ("sulu" için) diyebilirsiniz.
- Reaksiyon su varlığında meydana gelirse, iyonik bileşiğin çözeceği nitel bir çözünürlük tablosuna bakın. Yüksek oranda çözünür ise, bileşik sulu olacaktır (aqAksi takdirde, katı için "s" işaretli olmanız gerekir.
- Denklemde su yoksa, iyonik bileşik katı haldedir (s).
- Egzersiz bir asit veya bir bazdan bahsedilirse, bileşik sulu olacaktır (aq).
- Bir örnek verelim: 2Cr + 3NiCl2 -> 2CrCl3 + 3Ni. Temel formlarında, Cr ve Ni katıdır. NiCl2 ve CrCl3 çözünür iyonik bileşiklerdir, bu yüzden suludür. Denklemi şu şekilde yeniden yazabiliriz: 2Cr(s) + 3NiCl2(aq) -> 2CrCl3(aq) + 3Ni(s)
-

Ayrışan kimyasal türleri belirler. Bir çözümde, her zaman ayrışan bileşikler vardır (katyonlarda ve anyonlarda). Bir tür veya bir bileşik ayrıldığında, pozitif iyonlara (katyonlar) ve negatif iyonlara (anyonlar) ayrılır. Elektrik dengesinin daha sonra restore edilmesi gerekecektir, ki bu net iyonik denklemde yapılır.- Katılar, sıvılar, gazlar, moleküler bileşikler, düşük çözünürlükte iyonik bileşikler, poliamerik iyonlar ve zayıf asitler ayrışmazlar.
- Yüksek çözünürlüğe sahip iyonik bileşikler (çözünürlük tablosunu kontrol etmek için) ve güçlü asitler hepsini toplar: HC1(aq), HBr(aq), HI(aq), H2SO4(aq), HClO4(aq) ve HNO3(aq) .
- Bununla birlikte, eğer poliatomik iyonlar ayrışmazlarsa, saltera olmadan, içinde bulundukları bileşiği koparacaklarını unutmayın.
-

Ayrışmış her iyonun yükünü hesaplayın. Metallerin çoğu katyon verirken metallerin her zaman katyon verdiğini unutmayın. Her bir elementin yükünü bilmek için periyodik elementler tablosunu kullanın. Daha sonra, bileşik içindeki her bir iyonun yüklerini dengelemeniz gerekecektir.- Örneğimize bakalım. NiCl2 CrCl bir tarafta Ni ve Cl verecek3 Cr ve Cl'ye ayrışacaktır.
- Nikel (Ni) 2+ yüke sahipse, bu yük, her biri tek bir negatif yüke sahip olan (1-) iki klorin iyonuyla telafi edilir. Benzer şekilde, aslan kromu (Cr) 3+ yüke sahiptir, bu yüzden üç negatif iyon kloru vardır.
- Polyatomik iyonların belirli bir yükü olduğunu unutmayın.
-

Denklemi yazın. Şimdi iyonlara ayrışmış, elde edilen çözeltinin tüm iyonik bileşiklerini belirterek yazın. Ayrışması veya zionize olması gereken (güçlü asitler) her şey iki ayrı iyona ayrılacaktır. Maddenin durumu aynı kalacaktır (aqgeri kalan tek şey denklemin dengeli kaldığını kontrol etmektir.- Katılar, sıvılar, gazlar, zayıf asitler ve düşük çözünürlükte iyonik bileşikler durumu değiştirmez veya iyonlara ayrılmaz, bu yüzden onları değiştirmeden bırakmanız gerekir.
- Moleküler maddeler çözeltide çözülür, böylece durum sulanır (aq). Bu kuralın üç istisnası vardır: CH4(g), C3'H8(g) ve C8'H18(l) sulu biçimde sona ermeyecektir.
- Örneğimize bakalım. İyonik denklem şimdi: 2Cr(s) + 3Ni(aq) + 6Cl(aq) -> 2Cr(aq) + 6Cl(aq) + 3Ni(s). Bir bileşiğin bileşeni olmadığında, klor iki atomlu değildir. Bu yüzden katsayılarını, denklemin her bir tarafında 6 Cl iyon veren bileşikte bulunan datom sayısı ile çarptık.
-

Seyirci iyonlarını yok edin. Bunlar, reaksiyon sırasında reaksiyona girmeyen iyonlardır. Onları denklemin her iki tarafında ortadan kaldırabiliriz. Tek sınır, yalnızca özdeş iyonların (sorumlu ve indeks içinde) elimine edilebilir olmasıdır. Bu seyirci iyonları olmadan denklemi tekrarlayın.- Aldığımız örnekte, her iki tarafta 6 Cl izleyici iyon var. Tepki vermediler, denklemden kaybolmalarını sağlayabiliriz. Net iyonik denkleminiz: 2Cr(s) + 3Ni(aq) -> 2Cr(aq) + 3Ni(s)
- İyi çalıştığınızı doğrulamak için, toplam reaktif yükü (net iyonik denklemin solu), ürünlerinkine eşit olmalıdır (sağ).