İçerik
- aşamaları
- Yöntem 1 Reaksiyon hızını analiz edin
- Yöntem 2 Verilerden bir grafik çizmek
- Yöntem 3 Problemi deneysel olarak çözme
Kimyasal maddelerin konsantrasyonunun çeşitli kimyasal prosesleri anlamak için reaksiyon hızını nasıl etkilediğini bilmek çoğu zaman vazgeçilmezdir. "Reaksiyon sırası", bir veya daha fazla reaktifin konsantrasyonunun reaksiyon hızını nasıl değiştirdiği ile ilgilidir. Bir kimyasal reaksiyonun genel sırası, mevcut tüm reaktiflerin reaksiyon sırasının toplamıdır. Sırasını belirlemek için bir reaksiyonun denge denklemini gözlemlemeniz yeterli olmayacaktır, ancak bu bilgiyi reaksiyon hızından veya onu temsil eden grafikten öğrenebilirsiniz.
aşamaları
Yöntem 1 Reaksiyon hızını analiz edin
-

Hız denklemini analiz eder. Reaksiyon hızı denklemi, reaksiyon sırasını belirlemenize yardımcı olabilir. Bu denklem, geçen zamanın bir fonksiyonu olarak kimyasal maddelerden birinin artışını veya azalmasını vurgulamaya yarar. Bu reaksiyonla ilişkili başka hiçbir denklem, reaksiyon sırasını tanımlamanıza izin vermez. -

Reaktiflerin sırasını tanımlayın. Hız denklemindeki her bir reaktif, 0, 1 veya 2 üssüne sahip olacaktır (2'den büyük üslerle karşılaşması çok nadirdir). Yapmanız gereken tek şey, size her reaktifin sırasını söyleyen bu katılımcının değerini düşünmektir.- Eğer üs sıfır ise, söz konusu reaktifin konsantrasyonu reaksiyon hızını etkilemez.
- Üsse 1'e eşitse, bu, ilgili reaktif konsantrasyonunun arttırılmasının reaksiyon hızını doğrusal olarak arttırdığı anlamına gelir (konsantrasyonunu iki katına çıkarırsanız, reaksiyon hızını iki katına çıkarırsınız).
- Üst madde 2 ise, tepkime hızı, reaktifin konsantrasyonunu artırarak karesel olarak artar (konsantrasyonunu iki katına çıkarırsanız, hız 4 ile çarpılır).
- Sıfır güce yükseltilen herhangi bir sayı her zaman 1 olacağından çoğu zaman, hız denklemlerinde sıfır sıra reaktiflerinden bahsedilmez.
-

Tüm reaktiflerin sırasını ekleyin. Kimyasal reaksiyonun genel sırası, her bir reaktifin siparişlerinin toplamıdır. Bu nedenle, sadece kimyasal reaksiyonunuzun sırasını bulmak için tüm reaktiflerin üstlerini toplamalısınız. Genel olarak, bu sonuç 2'ye eşit veya daha azdır.- Örneğin, bir numaralı reaktifiniz birinci sıradaysa (yani, 1 üssünü alırsa) ve iki numaralı reaktifiniz de birinci derecedeyse (ayrıca 1'lik üsse sahiptir), o zaman genel reaksiyon ikinci derece olacaktır.
Yöntem 2 Verilerden bir grafik çizmek
-

Doğrusal bir fonksiyonla reaksiyonu temsil eden değişkenleri bulun. Reaksiyonu temsil eden grafiğin, artış hızı sabit olduğunda doğrusal olduğu söylenir. Başka bir deyişle, bağımlı değişkenin birinci saniyede, ikinci, üçüncü vb. Kadar değişeceği anlamına gelir. Görsel olarak, çizgi grafik sayfada düz bir çizgi olarak görünecektir. -
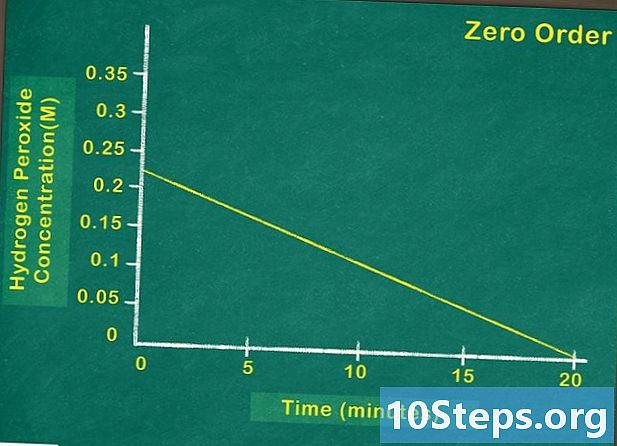
Zamanla reaktif konsantrasyonunu gösterir. Grafikte, reaksiyonun herhangi bir anında kalan reaktif miktarını görebilirsiniz. Grafikte temsil edilen fonksiyon doğrusal ise, bu reaktif konsantrasyonunun reaksiyon hızını etkilemediği anlamına gelir. Bu nedenle sıfır derecelik bir reaktifle karşı karşıya kalırsınız. -
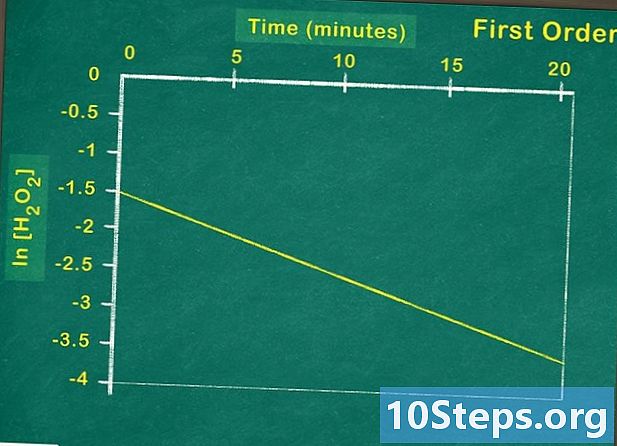
Doğal logaritmayı çizin. Eğer reaktif konsantrasyonunun doğal logaritmasını zamanın bir fonksiyonu olarak temsil ediyorsanız, lineer bir fonksiyon elde ederseniz, bu reaktifin birinci dereceden olduğu anlamına gelir. Böyle değilse, grafiğinizden bunun ikinci dereceden bir reaksiyon olduğunu kontrol etmeniz gerekir. -

Reaktif konsantrasyonunun zamana karşı tersini gösterir. Buna karşılık gelen işlev doğrusal bir işlevse, ikinci dereceden bir reaksiyonla ilgilendiğiniz içindir. Bu nedenle, reaksiyon hızı, reaktif konsantrasyonundaki artışa bağlı olarak karesel olarak artacaktır. Bulduğunuz işlev doğrusal değilse, bunun nedeni sıfır dereceli veya birinci dereceden bir reaksiyondur. -

Tüm reaktiflerin siparişlerini toplayın. Tüm reaktifler için doğrusal bir fonksiyon belirledikten sonra, bunların her birinin sırasını öğrenebilirsiniz. Daha sonra genel siparişi hesaplayabilirsiniz. Yapmanız gereken tek şey, reaksiyonunuzun genel sırasını almak için farklı reaktiflerin siparişlerini bir araya getirmektir.
Yöntem 3 Problemi deneysel olarak çözme
-

Birinci dereceden bir reaktif bulun. Reaktiflerden birinin konsantrasyonu iki katına çıkarsa, reaksiyonun hızı ikiye katlandığında reaksiyonun sırasının ne olduğunu bulun. Bir reaktifin konsantrasyonunun iki katına çıkarılması ve reaksiyon oranının iki katına çıkarılması reaktifin birinci sırada olduğu anlamına gelir. Bu durumda, her iki reaktif de birinci derecedendir. Bu nedenle, bu iki birinci dereceden reaktifin toplamının, ikinci dereceden bir kimyasal reaksiyona neden olduğu sonucuna varabilirsiniz. -

Sıfır sipariş reaktifi bulun. Her iki reaktifin konsantrasyonunu iki katına çıkarırken reaksiyon hızında herhangi bir değişiklik meydana gelmeyen bir reaksiyonun sırasını belirleyin. Reaktiflerden birinin konsantrasyonunun iki katına çıkması, reaksiyon hızında bir değişikliğe neden olmazsa, söz konusu reaktifin sıfır sırada olduğu anlamına gelir. Bu durumda, iki reaktif sıfır derecelidir. İki sıfır dereceli reaktif karıştırılırsa, sıfır dereceli bir global kimyasal reaksiyon elde edilir. -

İkinci dereceden bir reaktif bulun. Hangi sıranın reaktiflerden biri iki katına çıktığında hızı dört kat olduğu bir reaksiyon olduğunu bulun. Böylece reaksiyon hızını etkileyen reaktif ikinci derecedendir. Diğer reaktif bu durumda etkili olmayacak ve sıfır sırayla olacaktır. Bu iki reaktifin emirlerinin toplamı iki olacaktır, bu küresel olarak ikinci derece bir kimyasal reaksiyon olduğu anlamına gelir.