İçerik
- aşamaları
- Yöntem 1 Denemeyi deneme ve yanılma yöntemiyle dengeleme
- Yöntem 2 Bir denklemi cebirsel metotla dengeleyin
Kimyada, bir denklem bir kimyasal reaksiyon sırasında olanları belirler. Denklemin soluna, deneme için kullanılan reaktifleri ve sağa, deneme sırasında elde edilen ürünleri yerleştiririz. Kimyasal bir reaksiyon sırasında kütlenin (Lavoisier) korunumu ilkesine göre, hiçbir atom kaybolmaz, hiçbiri yaratılmaz, farklı birleşirler. Özet olarak, denklemin solunda, sağda her bir elemanın aynı sayıda datomuna sahip olmalısınız. Bu yüzden bir denge denkleminin daima dengelenmesi gerekir.
aşamaları
Yöntem 1 Denemeyi deneme ve yanılma yöntemiyle dengeleme
-
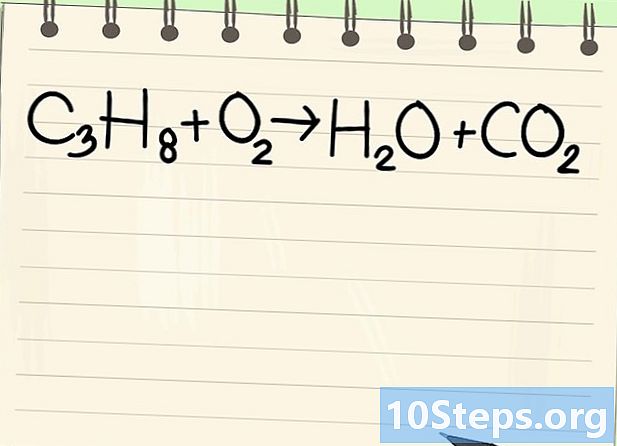
Denge denklemine dikkat edin. Aşağıdaki denklemi ele alacağız:- C3'H8 + O2 -> H2O + CO2
- Bu propan yanma denklemidir (C3'H8) oksijende: su ve karbondioksit elde edilir.
-
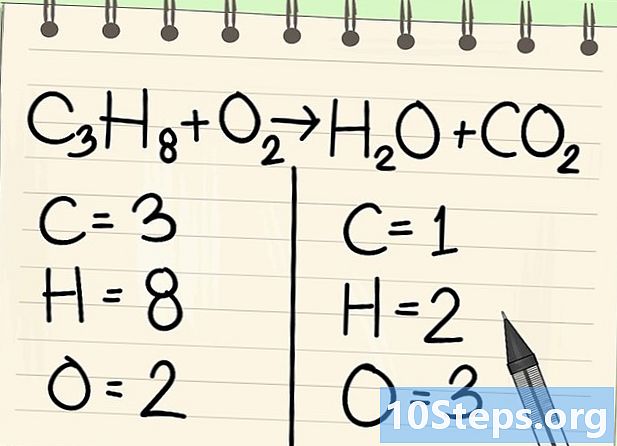
Atomları say. Denklemin bir tarafındaki her bir elemanın datom sayısını, ardından diğerini girin. Bunun için endeksleri dikkate alın, eğer yoksa, indeks 1'dir.- Solda 3 karbon atomu, 8 hidrojen ve 2 oksijen var.
- Sağ tarafta 1 atom karbon, 2 hidrojen ve 3 oksijen var.
-
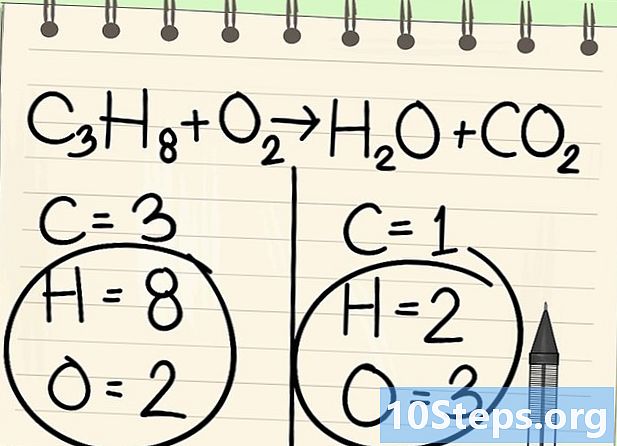
Hidrojen ve oksijeni geçici olarak bir kenara bırakın. -

Doğru elemanla dengelemeye başlayın. Reaksiyondan önce ve sonra daima bir molekülde bulunanla başlarız. Birkaç tane varsa, moleküllerden birinde monovalent olanı alın. Burada karbon atomları ile başlıyoruz. -

Karbon atomlarını dengeleyin. Sağdaki karbondioksit molekülüne bir katsayısı ekleyin (CO2) karbon latomun yalnız olduğu. 3 sol atomu elde etmek için 3 koyacağız.- C3'H8 + O2 -> H2O + 3CO2
- Böylece sağdaki 3 karbon atomu katsayısı (3CO) sayesinde2) ve indeks sayesinde solda 3 karbon atomu3'H8).
- Bir denklemde, istediğiniz tüm katsayıları koyabilirsiniz, ancak ipuçlarına dokunamazsınız.
-
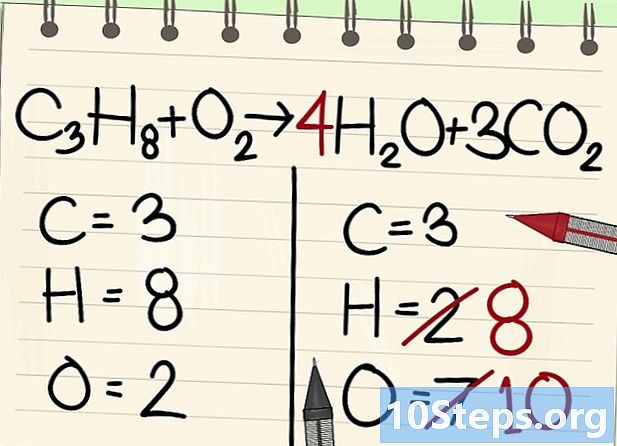
Hidrojen atomlarını dengeleyin. Denklemden 8 tane kaldıysanız, sağa ihtiyacınız var.- C3'H8 + O2 --> 4'H2O + 3CO2
- Sağda, 4 katsayısı koyacaksınız, çünkü hidrojen su molekülünde iki değerlidir: endeks 2, iki hidrojen atomunun ilişkili olduğunu gösterir.
- Sağdaki hidrojen atomu sayısını elde etmek için, katsayı 4'ü indeks 2 veya 8 atom ile çarpın.
- Oksijen atomlarına gelince, sağda, bir tarafta 6, 3CO'nun üç molekülünden geliyor2 (3 x 2 = 6 atom) ve 4 4 H 4 molekülünden2O (4 x 1 = 4 atom), yani toplam 10 atom oksijen.
-
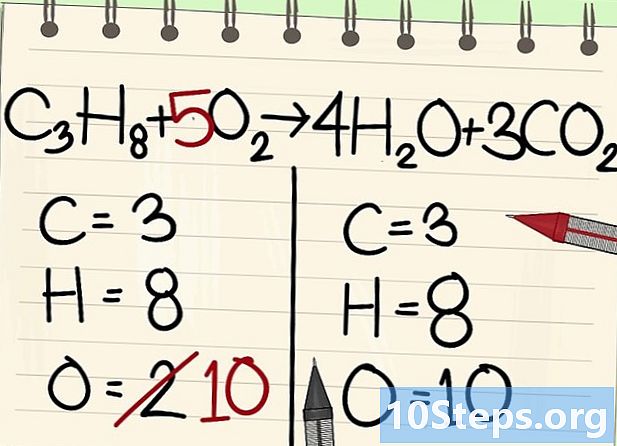
Oksijen atomlarını dengeleyin.- Karbon ve hidrojen dengesi nedeniyle, oksijen atomlarının sayısı denklemin her iki tarafında aynı değildir. Daha önce sağda 10 oksijen atomu olduğunu gördük (su moleküllerinden 4, karbondioksit moleküllerinden 6). Solda, sadece 2 var (O2).
- Oksijeni dengelemek için, sol oksijen molekülüne 5 katsayısı ekleyin: solda diğerinde sağda 10 oksijen atomu var.
- C3'H8 + 5Ey2 -> 4H2O + 3CO2
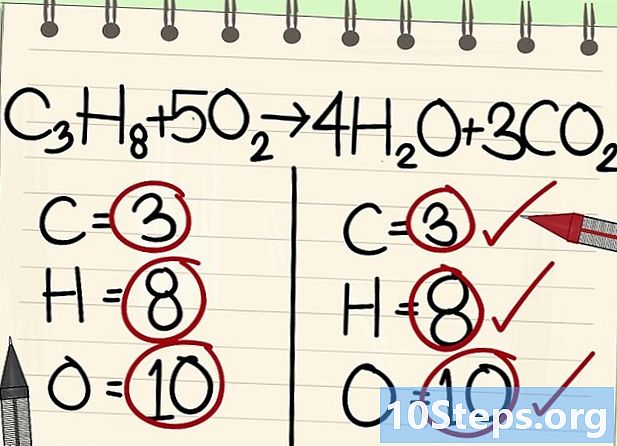
- Tüm atomlar (karbon, hidrojen ve oksijen) dengelidir: denkleminiz dengelidir.
Yöntem 2 Bir denklemi cebirsel metotla dengeleyin
-

Denklemi dengeye yaz. Her moleküle bir hazır bilgi katsayısı atayın. Onları arayacağız vardır, b, c ve d. -
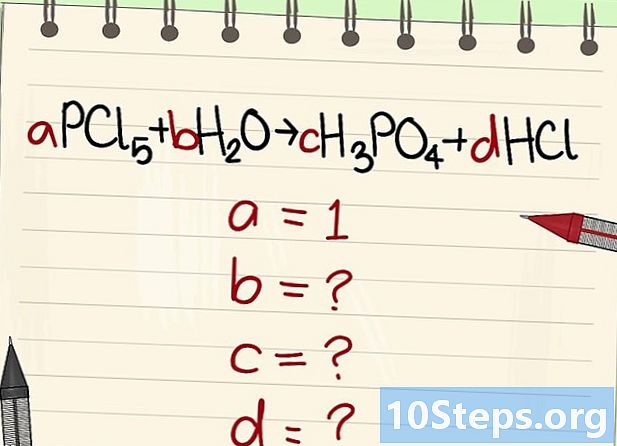
Diğer değişmez katsayıların değerini bulun. Bunu soracağız vardır = 1. -

Bu katsayılar arasındaki ilişkileri bulun. Sola (reaktifler) ve sağa (ürünler) bakarak, bu farklı katsayılar arasındaki ilişkileri kurun.- Aşağıdaki denklemi alın: aPCl5 + bH2O = cH3P04 + dHCl. A = 1 olduğu, yani c = a, d = 5a ve 2b = 3c + d olduğu belirtildi. Hesaplamalar yapıldı, c = 1, d = 5 ve b = 4.

- Aşağıdaki denklemi alın: aPCl5 + bH2O = cH3P04 + dHCl. A = 1 olduğu, yani c = a, d = 5a ve 2b = 3c + d olduğu belirtildi. Hesaplamalar yapıldı, c = 1, d = 5 ve b = 4.