İçerik
Kimyada, elektronegatiflik bir atomun bir bağdaki elektronlara uyguladığı çekimin bir ölçüsüdür. Yüksek elektronegatifliğe sahip bir atom, elektronları büyük yoğunlukta çekerken, düşük elektronegatifliğe sahip bir atom bunu çok az yoğunlukla yapacaktır. Bu değerler, farklı atomların birbirine bağlandığında nasıl davranacağını tahmin etmek için kullanılır ve bu konuyu temel kimyada önemli bir beceri haline getirir.
adımlar
Yöntem 1/3: Elektronegatifliğin Temel Kavramları
Atomlar elektron paylaştığında kimyasal bağların gerçekleştiğini anlayın. Elektronegatifliği anlamak için, önce bir "bağ" ın ne olduğunu anlamak önemlidir. Moleküler diyagramda birbirine "bağlı" bir moleküldeki herhangi iki atomun aralarında bir bağ olduğu söylenir. Esasen, bu, iki elektron setini paylaştıkları anlamına gelir - her atom bağa bir atom katkıda bulunur.
- Atomların neden elektron paylaşıp birbirlerine bağlandığına dair kesin nedenler bu makalenin odak noktasıyla uyuşmuyor. Daha fazlasını öğrenmek istiyorsanız, kimyasal bağların temel kavramlarını internette araştırın.

Elektronegatifliğin bağda bulunan elektronları nasıl etkilediğini anlayın. İki atom bir bağda iki elektron setini paylaştığında, ikisi arasında her zaman eşit bir paylaşım olmaz. Bunlardan biri bağlı olduğu atomdan daha yüksek bir elektronegatifliğe sahip olduğunda, iki elektronu kendisine yaklaştırır. Çok yüksek elektronegatifliğe sahip bir atom, elektronları bağda kendi tarafına çekebilir ve neredeyse diğeriyle paylaşımı iptal edebilir.- Örneğin, NaCl (sodyum klorür) molekülünde, klor atomu yüksek bir elektronegatifliğe ve sodyum, düşük bir elektronegatifliğe sahiptir. Yakında elektronlar çekilecek klora doğru ve sodyumdan uzak.

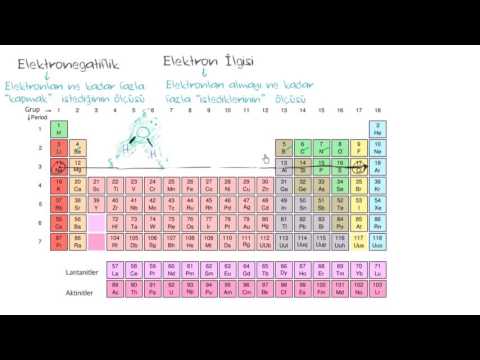
Referans olarak bir elektronegatiflik tablosu kullanın. Elektronegatiflik tablosu, elementleri tam olarak periyodik tablo gibi düzenlenmiş, ancak her atom elektronegatifliği ile etiketlenmiş olarak sunar. Çeşitli kimya ders kitaplarında, teknik makalelerde ve ayrıca internette bulunabilirler.- İşte mükemmel bir elektronegatiflik tablosu. Daha yaygın olan Pauling elektronegatiflik ölçeğini kullandığını unutmayın. Bununla birlikte, elektronegatifliği ölçmenin başka yolları da vardır, bunlardan biri aşağıda gösterilecektir.

Tahminleri kolayca yapmak için elektronegatiflik eğilimlerini hatırlayın. Elinizde bir elektronegatiflik tablonuz yoksa, bu değeri periyodik tablodaki konumunuza göre tahmin etmek yine de mümkündür. Genel bir kural olarak:- Bir atomun elektronegatifliği artışlar hareket ederken sağ periyodik tabloda.
- Bir atomun elektronegatifliği artışlar hareket ederken yukarı periyodik tabloda.
- Bu nedenle, sağ üst köşedeki atomlar en yüksek elektronegatiflik değerlerine ve sol alt köşedekiler en düşük olana sahiptir.
- Örneğin, önceki NaCl örneğinde, klorun sodyumdan daha yüksek bir elektronegatifliğe sahip olduğunu, çünkü neredeyse en doğru noktada olduğunu belirleyebilirsiniz. Öte yandan, sodyum, tablonun çok solundadır ve bu da onu en az değerli atomlardan biri yapar.
Yöntem 2/3: Elektronegatiflik ile Bağlantıları Bulma
İki atom arasındaki elektronegatiflik farkını bulun. İki atom birbirine bağlandığında, elektronegatiflik değerleri arasındaki fark, bu bağın kalitesi hakkında çok şey ortaya çıkarır. Farkı bulmak için en küçük değeri en büyüğünden çıkarın.
- Örneğin, HF molekülüne bakarsak, hidrojenin (2.1) elektronegatiflik değerini florin (4.0) değerinden çıkaracağız. 4.0 - 2.1 = 1,9.
Fark 0,5'in altındaysa, bağ kovalenttir ve polar değildir. Burada elektronlar neredeyse eşit ölçülerde paylaşılır. Bu bağlar, her iki ucunda da büyük farklılıklar olan moleküller oluşturmaz. Kutupsal bağların kopması genellikle çok zordur.
- Örneğin, O molekülü2 bu tür bir bağlantı sunar. İki oksijen molekülü aynı elektronegatifliğe sahip olduğundan, aralarındaki fark 0'a eşittir.
Fark 0,5 ile 1,6 arasında ise, bağ kovalent ve kutupsaldır. Bu bağlar, bir uçta diğerine göre daha fazla elektron tutar. Bu, molekülü sonunda daha fazla elektronla biraz daha negatif ve onlar olmadan sonunda biraz daha pozitif hale getirir. Bu bağlardaki yük dengesizliği, moleküllerin bazı spesifik reaksiyonlara katılmasına izin verir.
- Buna güzel bir örnek H molekülüdür2O (su). O, iki H'den daha elektronegatiftir, bu nedenle elektronları daha yakın tutar ve tüm molekülü O ucunda kısmen negatif ve H uçlarında kısmen pozitif yapar.
Fark 2'den büyükse bağ iyoniktir. Bu bağlarda elektronlar tamamen bir uca yerleştirilmiştir. En elektronegatif atom negatif bir yük kazanır ve en az elektronegatif atom pozitif bir yük kazanır. Bu tür bir bağ, atomların diğer atomlarla reaksiyona girmesine veya ayrıca polar atomlarla ayrılmasına izin verir.
- NaCl (sodyum klorür) buna bir örnek. Klor o kadar elektronegatiftir ki, her iki elektronu da bağdan birbirlerine doğru çekerek sodyumun pozitif yüklü kalmasını sağlar.
Fark 1,6 ile 2 arasındaysa, bir metal arayın. Eğer Orada bağda bulunan bir metal, bu onun iyonik. Başka metal olmayanlar varsa, bağ Kutupsal kovalent.
- Metaller, periyodik tablonun solundaki ve ortasındaki atomların çoğunu içerir. Bu sayfada hangi elementlerin metal olduğunu gösteren bir tablo vardır.
- Önceki HF örneğimiz bu gruba giriyor. H ve F metal olmadığından bağ, Kutupsal kovalent.
Yöntem 3/3: Mulliken Elektronegatifliğini Keşfedin
Atomunuzun ilk iyonlaşma enerjisini bulun. Mulliken elektronegatifliği, yukarıdaki Pauling tablosunda bulunandan biraz farklı bir ölçüm yönteminden oluşur. Belirli bir atom için değerini bulmak için ilk iyonlaşma enerjinizi bulun. Bu, atom boşalmasını tek bir elektron yapmak için gereken enerjidir.
- Bu değer muhtemelen kimyasal referans materyallerinde bulunabilir. Bu sayfada kullanabileceğiniz iyi bir tablo var (bulmak için aşağı kaydırın).
- Örnek olarak, lityumun (Li) elektronegatifliğinin ne olduğunu bulmak istediğinizi varsayalım. Yukarıdaki sayfadaki tabloda, ilk iyonlaşma enerjisinin eşdeğer olduğunu görebiliriz 520 kJ / mol.
Atomun elektron ilgisinin ne olduğunu öğrenin. Bu, negatif bir iyon oluşturmak için atoma bir elektron eklendiğinde elde edilen enerjinin bir ölçüsüdür. Yine, bu referans materyallerde bulunması gereken bir şeydir. Bu sayfada yararlı olabilecek kaynaklar var.
- Lityumun elektronik afinitesi şuna eşittir: 60 kJ mol.
Mulliken'in elektronegatiflik denklemini çözün. Bir enerji birimi olarak kJ / mol kullanıldığında, Mulliken'in elektronegatiflik denklemi şu şekilde yazılabilir: TRMulliken = (1,97 × 10) (Eben + Eve) + 0,19. Bilinen verileri denkleme ekleyin ve EN'nin değerini bulunMulliken.
- Örneğimizde, aşağıdaki çözüme ulaşacağız:
- TRMulliken = (1,97 × 10) (Eben + Eve) + 0,19
- TRMulliken = (1,97 × 10)(520 + 60) + 0,19
- TRMulliken = 1,143 + 0,19 = 1,333
- Örneğimizde, aşağıdaki çözüme ulaşacağız:
İpuçları
- Pauling ve Mulliken ölçeklerine ek olarak, Allred-Rochow, Sanderson ve Allen gibi başka elektronegatiflik ölçekleri de vardır. Her birinin elektronegatifliği hesaplamak için kendi denklemleri vardır (ve bazıları oldukça karmaşık olabilir).
- Elektronegativite ölçü birimi yok.


